Tungsten Bronze

Einführung
Die Wolframbronzen sind eine Gruppe von Verbindungen aus Wolframtrioxid, WO3, und ein Alkalimetall, wie Natrium (Na), Kalium (K), Rubidium (Rb) oder Cäsium (Cs) hergestellt. Die allgemeine chemische Form ist MxW03, wobei M = Na, K, Rb oder Cs, und 0 <x <1. Die Farbe dieser Verbindungen mit der Zusammensetzung variiert, bei x = 0,93 ist die Farbe ein bronzelike goldgelb; bei x = 0,32 ist die Farbe blau-violett.
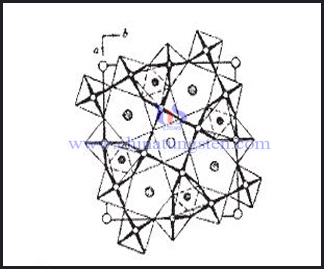
Die Variation der Zusammensetzung betrifft auch die Struktur der Verbindung. Stellen Sie sich ein Würfel mit einer Wolframatom an jeder Ecke, einem Sauerstoffatom in der Mitte jeder Kante und ein Atom eines Alkalimetalls in der Mitte des Würfels. Jedoch in einem Wolframbronze besteht kein Atom in der Mitte eines jeden Würfels. Wenn x <1 ist, nur eine bestimmte Fraktion der Würfel wird ein Alkaliatom enthalten. Wenn x groß ist, nahe 1 wird die Struktur des Kristallgitters kubisch sein. Als x abnimmt, werden weniger von den Würfeln gefüllt, die Strukturänderungen. Bei etwa x <0,3, oder mit weniger als 30% der vollen Würfel wird die Struktur hexagonal, mit Atomen in hexagonalen Platten angeordnet.
Die kubische Anordnung mit einem Atom in der Mitte eines Würfels oben beschrieben ist typisch für Perovskite, eine Gruppe von Keramikmaterialien mit einer Vielzahl von interessanten elektrischen Eigenschaften. Die Hochtemperatur-Supraleitern sind unter diesen. In der kubischen Phase, Wolframbronzen sind metallisch und leiten Strom. Jedoch in der hexagonalen Phase, werden sie supraleitend.
Einstufung
Tungsten Bronze hat spezielle Raumtunnelstruktur, durch kristalline Struktur klassifiziert, kann es in Perowskit Wolframbronze (PTB), tetragonalen Wolframbronze (TTB), hexagonal Wolframbronze (HTB) und Verwachsung Wolframbronze (ITB) unterteilt werden. PTB und HTB gehören zu speziellen nicht-stoichiometricm Wolframbronze in die gleiche Kategorie wie nicht stoichiometricmn Verbindung geteilt werden. W existiert als W6 +, W5 + und W4 + in Wolframbronze die elektrische Ladung der Verbindung zu balancieren. Tunnelstruktur und ihre besondere Wertigkeit macht es haben hervorragende elektrische und ionenleitende Eigenschaft, supraleitende und photochromen Eigenschaften. Seine Anwendung in Speicherbatterie, Elektrochromie und chemischen Sensor hat große Aufmerksamkeit auf sich ziehen.
1. Nicht-stoichiometricmn Verbindung
PTB und HTB speziellen nicht-stoichiometricmn Wolframbronze sind, seine chemische Formel ist MxWO3 (0 <x <1) kann M Alkalimetall wie K, Na sein, oder Ca, Sr, Ba und andere seltene Erdmetalle wie Cu, Ag, H. Sie hohe elektrisch leitende Eigenschaft und schnellen Ionentransporteigenschaften haben, seine elektrisch leitenden Rate 2.5X106 S / m erreichen, die zu niedrigen Temperatur Superleiter gehört.
2. Verwachsung Wolframbronze
ITB enthält B2O62- Mangel an O fällig ist oder die zusätzlichen Ionen B oder BO nimmt die größte freie Stelle der Verbindung. Normalerweise kann es als (AO) m sein. (B2O5) n oder (AO) m. (BO3) n entsprechend seiner Wertigkeit. BaO. Die wichtigsten Produkte sind (Nb2O5) 2, BaO. (Ta2O5) 2, Nb8W9O47.
3. Tetragonales Wolframbronze
TTB ist die meist in der Wolfram-Bronze-Struktur gesehen und verwendet wird, hat es sich der Schwerpunkt der Forschung und Entwicklung. Viele Orthogonalität Wolframbronze ist die Superstruktur von TTB, so wird es in TTB eingestuft.
Vorbereitung
1. Nasschemische Verfahren
Nasschemisches Verfahren wird zunächst bei der Herstellung von HxWO3 aufgetragen. Die gemeinsame naßchemischen Verfahren Herstellungsverfahren enthält die Schritte: Einweichen WO3 kristallin in Säure- und Metallpulver (Zn, Pb, Sn) Lösung, reagieren in speziellen Behälter (wie beispielsweise Jones-Reaktor kann zwischen Reaktant und Luft realisieren Trenn). Während der Verarbeitung tritt H in die freie Stelle von WO3. Beispielsweise H0.3WO3 hexagonaler Struktur kann durch hexagonal WO3, Salzsäure und Zn, hergestellt werden.
Vorläuferverbindung zersetzt sich in Lösung kann Wolframbronze erhalten. Beispielsweise APT (NH4) 10 (W12O41) 5H2O gemischt mit Lösung wie Eisessig und Erhitzen auf 200 ℃, können hexagonale Struktur (NH4) xWO3 erhalten werden.
Aufgrund der niedrigen Temperatur während des Syntheseprozesses ist das kristalline Zustand des Produktes besser, so dass die Verfahren im Fokus der Forschung geworden ist.
2. Thermische Reduktionsmethode
2.1 Phase-Phase Heizung Reduktionsverfahren
Unten ist der Herstellungsverfahren: Mischen WO3, Wolfram-Metallpulver oder WO2 und Wolframat aus Metall M, erhitzen Sie es bis 1000 ℃ unter Vakuumatmosphäre oder einer inerten Atmosphäre. Dann entfernen Sie die Verunreinigungen MxWO3 zu bekommen. Reaktionsgleichung ist:
x / 2M2WO4 + (1-x) WO3 + x / 2WO2 → MxWO3
2.2 Thermische Zersetzung Methode
Heizung Vorläuferverbindung wie HPAs Komplex, Peroxy-HPAs Komplex und andere komplexe Verbindung enthält, kann Wolfram Wolframbronze zersetzen. Das Verfahren zur thermischen Zersetzung von APT Wasserstoff Wolframbronze zu erhalten enthält folgende Schritte:
1) Heizung APT: (NH4) 10 (H2W12O42) 7H2O unter 100 ~ 200 ℃ zu erhalten (NH4) 10 (W12O41) 5H2O;
2) (NH4) 10 (W12O41) 5H2O wird fortgesetzt in (NH4 zu zersetzen) 0.33WO3 unter 200-250 ℃;
3) Unter 250-575 ℃, (NH4) 0.33WO3 große Stabilität zeigt, verwandelt es sich in H0.33WO3 und WO3.
Unter denen (NH4) xWO3 kann in HxWO3 unter 150-350 ℃ mit Veränderungen in kristallinen Struktur zerlegt werden, chemische Formel lautet: (NH4) xWO3 = HxWO3 + xNH3 (g).
3. elektrochemische Verfahren
Elektrochemische Verfahren ist das häufig bei der Herstellung von Wasserstoffwolframbronze und Lithium Wolframbronze verwendet. Sein Herstellungsverfahren enthält: WO3 in Elektroden Umwandlung, dann WO3-Elektrode als Kathode verwendet, unter Verwendung von Graphit oder Pt als Anode, Elektrolyse in Sulfid oder Salpetersäure kann Wasserstoff Wolframbronze oder Lithium-Wolfram-Bronze, die chemische Gleichung ist wie folgt erhalten:
xH++WO3+xe=HxWO3
xLi++WO3+xe=LixWO3
Eigentum und Anwendung
Tungsten Bronze hat eine gute elektronische und ionische Leitfähigkeit, Supraleitung und optischen Eigenschaften, die breite Anwendung Aussichten hat. In dieser Performance von Wolframbronze, die Leitfähigkeit und Supraleitung wurden früher erforscht, vor allem die supraleitenden Eigenschaften, die den Schwerpunkt in den sechziger und siebziger Jahren geworden war. Zwar gibt es jetzt Berichte über Wolframbronze-Typ Leitfähigkeit und Elektronenleitung sind, ist die Leitfähigkeit und die Supraleitung nicht mehr der Hauptinhalt Leistungsstudien.
Tungsten Bronze wurde nach Gegenion eingebettet in WO3 unter bestimmten Bedingungen gebildet, und es hat färbt sich aufgrund der Absorption und Streuung des Lichts und der Intensität der Absorption und Streuung Änderung mit dem x-Wert-Wechsel, die auch Wolframbronze präsentieren verschiedene Farben macht . Optische Eigenschaften von Wolframbronze mehr im Vordergrund, da der Plasma-H +, Li +, Na + und Ag + Einbettungs, von denen es mehr Forschungen sind. In dem HxWO3 stärkste Absorption von Licht hat, gefolgt Li +. Lithium und Natrium Wolframbronze haben jedoch eine maximale Lichtabsorption bei x ≈ 0,6, während der Wasserstoff Wolframbronze nicht.
Elektrochromie-Gerät und Photochromie Vorrichtung als zwei wichtige Aspekte der Wolframbronze-Anwendungen ist die optische Leistung eines ihrer Grundprinzipien. Electrochromism Anwendungen im Zusammenhang mit Plasma H + und Li + elektrochemische reversible Einbettung auf WO3 Elektrode.
Optische Einbettung ist, dass Plasma-H +, Li + und Na + in WO3 reversibel Feststoff unter Bestrahlung mit Licht, das auch eine wichtige Leistung von Wolframbronze ist, und es ist die grundlegende Reaktionen Farblichtsystem, photoelektrischen Umwandlung und andere Anwendungen zu erreichen. Weil es die Mischung aus WO3 und Wolframbronze nach der Intervention ist, wurde dieser Effekt auch als optisches Dotierungsverfahren gesehen.
Neue Leistung von feuchtigkeitsempfindlichen Eigenschaften der sensiblen Natur von einigen Chemikalien kann auch Wolfram Bronze wirksame Anwendung in Feuchtemessgeräte, chemische Sensoren und anderen Geräten macht.